Le Formindep ne soutient pas les récentes prises de positions de François Pesty.
Quand l’hépatologie s’enhardit à propos de l’efficacité des nouveaux médicaments de l’hépatite C, mais reste muette sur les lourds liens d’intérêts qui l’unissent aux industriels
Alerté par les propos démesurés de quelques leaders d’opinion en hépatologie au sujet du bénéfice procuré aux patients par les nouveaux antiviraux dans l’hépatite C chronique, je commence par collecter leurs liens d’intérêts avec les firmes pharmaceutiques présentes sur ce marché juteux, dominé par l’américain GILEAD Sciences et son SOVALDI®. En tirant sur la pelote de laine, je découvre la construction sous son emprise à l’occasion de l’élaboration du rapport ministériel « DHUMEAUX », d’une « redoutable machine de guerre » à dilapider l’argent public pour maximiser leurs profits. L’absence totale de gestion par les pouvoirs publics des lourds conflits d’intérêts de ces hépatologues a conduit au désastre financier que l’on connaît (1 milliard d’euros en 2014) sans que l’on sache vraiment quel en sera le bénéfice pour les patients. Les sanctions devraient être immédiates : Invalidation des recommandations « DHUMEAUX », ré-évaluation par la commission de la transparence de la place de ces médicaments dans la thérapeutique et surtout de la cible de patients à traiter, à commencer par une actualisation des données épidémiologiques qui datent de plus de dix ans.

Introduction
Choqué par la lecture de l’article « La “révolution” des nouveaux traitements bouleverse la prise en charge de l’hépatite C » (ici), publié le 13 janvier 2015 par le quotidien « Le Parisien » et après avoir visionné deux vidéos postées lors d’une « conférence de presse en ligne » de l’APCH, « association (médicale) pour l’amélioration de la prise en charge des hépatites chroniques » à l’occasion de la « Paris Hepatitis Conference » qui s’est tenue au Palais des Congrès de la porte Maillot et relayée sans aucune retenue par Le Parisien, je décidais alors de mener quelques investigations.
En effet, j’avais pu lire et écouter des leaders d’opinion en hépatologie, mais aussi quelques patients plus ou moins « instrumentalisés », n’hésitant pas à parler de « guérison totale, définitive », « d’élimination de l’hépatite », « d’éradication du virus », et ce, grâce aux nouveaux traitements de l’hépatite C chronique, aux prix exorbitants faut-il le rappeler.
Personnellement, j’en étais resté à une plus prosaïque « indétectabilité virale prolongée » (le virus n’est plus détectable dans le sang 12 semaines après l’arrêt du traitement) chez 90% des patients (et 80% pour le petit nombre de patients inclus au stade de la cirrhose dans les essais thérapeutiques).
Mais, la maladie doit-elle se confondre avec l’agent pathogène ? Suffirait-il de faire disparaître du sang 3 mois après la fin du traitement le virus de l’hépatite C, pour être certain que le patient vive plus longtemps, évite un carcinome du foie, des greffes hépatiques, voie sa cirrhose ou sa fibrose régresser ?
Ayant lu au préalable le magnifique dossier réalisé en octobre 2014 par la revue indépendante Prescrire, aux titres très explicites de « Editorial – Spirale mortifère », « Sofosbuvir (SOVALDI®) : Actif sur le virus de l’hépatite C, mais une évaluation clinique incomplète », et « Traitement de l’hépatite C chronique : Ne pas se précipiter sur les nouveaux antiviraux quand il est raisonnable d’attendre », “Sofosbuvir (SOVALDI®) : un prix dangereux”, je décide alors d’examiner les références bibliographiques citées par la revue, et de compléter par une recherche bibliographique sur les deux dernières années dans la base de données PubMed.
L’association entre une réponse virologique prolongée (critère biologique « intermédiaire » ou dit « de substitution ») et la réduction de la mortalité ou de la morbidité (critère clinique « dur »), n’est en fait démontrée à ce jour qu’avec de « vieux » médicaments, l’interféron associé ou non à la ribavirine. Il faudra vraisemblablement attendre encore quelques années pour avoir confirmation (ou pas) de l’efficacité clinique des nouveaux antiviraux dans l’hépatite C chronique.
Le lecteur intéressé aussi par les aspects médicaux, trouvera en annexes à la fin de cet article un résumé des principaux travaux qui permettent aujourd’hui de contester les termes employés par les hépatologues.
Car, notre intention première résidait dans l’étude des liens d’intérêts et avantages perçus par les leaders d’opinion en hépatologie, à l’origine de leurs propos inappropriés, et également de mesurer à l’échelle d’un service médical de « pointe », le service d’hépatologie de l’hôpital Beaujon, les moyens engagés par les firmes pharmaceutiques (une telle estimation n’avait pas encore été publiée en France à notre connaissance).
Mais, de fil en aiguille, « en grattant » un peu sur le rapport « DHUMEAUX » qui a mis le feu à l’assurance maladie (un milliard d’euros de dépenses en 2014 sur le seul SOVALDI®), je suis encore ahuri de tout ce que j’ai pu découvrir. A vous d’en juger…
Plan de l’article
– Les propos excessifs et prématurés tenus par les hépatologues,
– Les avantages perçus des firmes et conventions signées avec elles par les hépatologues,
– Les terets-qui-l/avantages perçus et conventions signées par les principaux protagonistes du « rapport DHUMEAUX »,
– Epilogue : L’après « Rapport DHUMEAUX »
– Les anomalies, les bugs et les imperfections de la base de données Transparence.sante.gouv.fr, dont la gestion semble défectueuse,
– Annexes – Arguments médicaux permettant de qualifier d’excessifs et de prématurés les propos de type « guérison totale, définitive ; éradication du virus »,
Les propos excessifs et prématurés tenus par les hépatologues

Quelques propos très optimistes extraits de cet article :
Nathalie BOYER, hépatologue de l’hôpital Beaujon de Clichy : « une grande révolution parce qu’on est passé de quelques pour cent de guérison (avec les anciens traitements, ndlr) à plus de 90 »
Derrière des propos certes moins euphoriques, le Pr Marc BOURLIÈRE de l’hôpital Saint Joseph à Marseille, déplore de ne pouvoir traiter le plus grand nombre de patients : « Ce n’est pas la fin de l’hépatite C et ce n’est peut-être même pas le début de la fin, à cause de l’obstacle de l’accès aux nouveaux traitements ».
La rédaction : « Pour les malades en échec de traitement avec les anciennes thérapies, ces nouvelles molécules sont tout simplement “formidables”, note Alain, aujourd’hui définitivement débarrassé du virus »
Le Dr Pascal MÉLIN, vice-président de l’association SOS Hépatites, regrette « On a une puissance phénoménale mais paradoxalement, on n’a jamais été aussi impuissant », et critique : « On est en train d’organiser le rationnement financier, on fait porter sur les médecins l’incapacité d’assumer des choix politiques »
Le Pr Patrick MARCELLIN chef du service Hépatologie de l’hôpital Beaujon, organisateur du congrès « Paris Hepatitis Conference » et président de l’association APHC : « Tout cela va bouger, les prix très chers aujourd’hui (…) vont chuter, le nombre de patient va augmenter et les nouveaux traitements vont se banaliser »
Les vidéos de la conférence de presse en ligne postées (ici) par l’association médicale « APHC »
1ère Vidéo APHC « Hépatite C : le bout du tunnel »

Pr Tarik ASSELAH « Il y a eu des progrès très impressionnants, avec les nouveaux traitements, ça permet d’éliminer l’hépatite C dans plus de 90% des cas »
Le commentateur : « Alain a vaincu le virus grâce au tout nouveau traitement »
2ème vidéo « La victoire par l’innovation et l’accompagnement »

Malika « Guérie, totalement guérie »…, « chaque jour vous vous rendez compte que vraiment vous êtes guérie »
Alain « Aujourd’hui, c’est terminé quoi. Le dernier traitement a fonctionné et en fait le virus a disparu »
Le commentateur « Grâce à de tout nouveaux traitements, on peut aujourd’hui éliminer définitivement le virus, le Dr BOYER parle de révolution, le taux de réussite approche carrément les 100% »…, « En attendant, il est maintenant possible de guérir de l’hépatite C, ces traitements révolutionnaires redonnent le sourire à des milliers de patients »
Nathalie BOYER « C’est une très grande révolution, par ce qu’on passait de quelques pour cents de guérison à là plus de 90% et on s’approche de cent, on le sent… dans les 5 à 10 ans qui viennent on aura probablement une disparition, une éradication du virus C »…, « accès à la guérison »
Les 2 vidéos ont été réalisées pour l’APHC par l’agence LJ Communication
Ces vidéos en ligne accessibles à tous, pour le moins « racoleuses », ne font-elles pas explicitement la promotion du service d’hépatologie de l’hôpital Beaujon ? Et indirectement, en présentant un tableau « idyllique » des nouveaux traitements, les internautes ont peu d’obstacles sur la toile pour aller chercher les informations implicites et identifier les médicaments « miracles ». On est en droit de se demander si ces vidéos en libre accès sur Internet ne mériteraient pas de faire l’objet d’un contrôle aussi strict que celui prévu par la Loi sur les messages publicitaires diffusés à la télévision ?
Une 3ème vidéo de l’APHC avait été postée par LJ Scope, service d’information online de l’agence LJ Com, le 11 janvier 2013 sur Youtube : « (2013) – Révolution thérapeutique dans l’hépatite C : il est urgent d’organiser l’accès aux soins ! »

Pr MARCELLIN : « On peut guérir de l’hépatite C, et quand je parle de guérison, ça veut dire élimination complète du virus, éradication, sans rechute. Aujourd’hui, 70% de guérison… en moyenne. Demain, c’est probablement dans 3-4 ans, ce sera 90 à 100% de guérison, on va approcher des 100% de guérison ».
Pr Tarik ASSELAH « Il y avait le traitement classique et ancien de l’hépatite C, deux médicaments, l’interféron en injection et des comprimés de ribavirine qu’on prenait matin et soir. Cette trithérapie, c’est en plus de ces deux médicaments, de nouvelles antiprotéases. Et vous avez deux familles d’antiprotéases qui sont le télaprévir et le bocéprévir, qui sont soit l’un soit l’autre en addition de cette bithérapie ». Ainsi, le PU-PH n’hésite pas à citer les dénominations communes des nouvelles antiprotéases dans un média audiovisuel accessible au grand public. Est-ce licite ?
4ème vidéo, postée sur le site de l’AFEF, Association Française d’Etude du Foie, avec présentation par le Dr Lawrence SERFATY « Surveillance des malades guéris de l’hépatite C »

Mensonge par omission.
Ce que ne dit pas le Dr SERFATY : Les études prises en compte dans cette méta-analyse ont été faites avec l’interféron alfa associé ou non à la ribavirine, et pas avec les nouveaux antiviraux !
(Explication en annexes)
Plus la ficelle est grosse, mieux ça passe !
Un point intéressant, SERFATY admet à plusieurs reprises que l’éradication du virus n’empêche pas chez un certain nombre de patients l’évolution défavorable de la maladie (cirrhose, carcinome hépatocellulaire, morbi-mortalité…)
Les avantages perçus des firmes et conventions signées avec elles par les hépatologues
Le tableau suivant vous permettra de mieux situer les différentes firmes pharmaceutiques actives dans le domaine du traitement antiviral de l’hépatite C chronique :
| DCI | Nom de marque | Firme | Dates de mise sur le marché | Forme / Voie d’admin |
|---|---|---|---|---|
| ribavirine | REBETOL® COPEGUS® | MSD France Roche SAS | AMM 04/1999 AMM 09/2003 | Gélule / per os |
| peginterféron alpha | VIRAFERONPEG® PEGASYS® | MSD France Roche SAS | AMM 09/2000 et 12/2002 AMM 04/2003 et 01/2012 | Sol inj stylo ou nec. Sol inj stylo ou ser. |
| bocéprévir | VICTRELIS® | MSD France | AMM 08/2011 | Gélule / per os |
| télaprévir | INCIVO® | Janssen-Cilag | AMM 07/2012 Arrêt au 30/04/2015 | Comprimé / per os |
| sofosbuvir | SOVALDI® | Gilead Sciences | AMM 01/2014 | Comprimé / per os |
| siméprévir | OLYSIO® | Janssen-Cilag | AMM 06/2014 | Gélule / per os |
| faldaprévir | Boehringer Ingelheim | Retrait demande AMM européenne 06/2014 | ||
| daclatasvir | DAKLINZA® | Bristol-Myers quibb | AMM 10/2014 | Comprimé / per os |
| sofosbuvir + lédipasvir | HARVONI® | Gilead Sciences | AMM 12/2014 | Comprimé / per os |
| asunaprévir | BMS-650032 | Bristol-Myers Squibb | ATU nominative 2013 | Gélule / per os |
| dasabuvir | EXVIERA® | Abbvie | ATU cohorte 12/2014 | Comprimé / per os |
| Ombitasvir / paritaprévir / ritonavir | VIEKIRAX® | Abbvie | ATU cohorte 12/2014 | Comprimé / per os |
Source : Thériaque®
Cliquer ici (fichier xls) pour ouvrir le fichier détaillé des avantages perçus par les 5 hépatologues cités dans l’article du Parisien et/ou intervenant dans les trois premières vidéos, ainsi que les 29 médecins du service d’hépatologie de l’hôpital Beaujon (CLICHY, 92) répertoriés dans les annuaires de l’Assistance Publique – Hôpitaux de Paris (Cliquer dans les cellules chiffrées pour obtenir le détail des avantages perçus, passer la souris sur les cellules pour voir en commentaires la liste des généreux bienfaiteurs…)
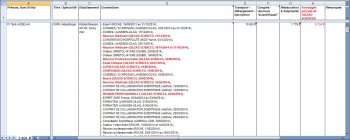
Au total, et sur la période 2012, 2013 et 2014 :
- Les 5 hépatologues leaders d’opinion de Clichy, Marseille et Saint-Dizier, interviewés dans l’article du Parisien ou présents dans les deux vidéos de l’association APHC, ont perçu 47.618 € d’avantages (38.732 € en titres de transport, hébergement et inscriptions et 8.886 € en restauration / hospitalité) soient près de 10.000 euros en moyenne par hépatologue. Avec 19.888 €, la firme Gilead Sciences a distribué 41,3% des avantages perçus. Nos 5 spécialistes du foie ont également signé 184 conventions avec les firmes pharmaceutiques, des agences de communication, des instituts de sondage, des sociétés de Marketing, sur des contrats ayant pour objet des prestations « d’expert », « d’orateur » dans les congrès, de « Conseil », de « Recherche », « présence dans les congrès », « Réunions professionnelles ou médicales ». Le montant de ces contrats n’a pas été divulgué…
- Les 29 médecins avec ou sans consultation du service d’hépatologie de l’hôpital Beaujon, à Clichy, répertoriés dans l’annuaire des médecins de l’Assistance Publique – Hôpitaux de Paris (ici, et là), et la médecin psychologue présente dans la deuxième vidéo, ont perçu au total 75.941 € d’avantages (58.977 € de frais de transport, d’hébergement et d’inscription, ainsi que 16.964 € en restauration ou hospitalité). Gilead Sciences avec 27.371 € a supporté 36,0 % des frais. Surtout, pas moins de 257 conventions ont été signées sur 3 ans entre 23 médecins du service d’hépatologie de Beaujon et les firmes pharmaceutiques ou leurs prestataires en service Marketing (une moyenne de 9 par médecin, ou de 3 par médecin et par an). Sur les 29 médecins, seuls 4 n’ont ni avantage perçu, ni convention déclarée dans la base de données transparence.gouv.sante.fr, et seuls 6 médecins (21%) n’ont signé aucune convention avec l’industrie…
Pour les 5 hépatologues leaders d’opinion, 161 (89%) des conventions signées le sont avec les 6 firmes commercialisant des médicaments indiqués dans le traitement antiviral de l’hépatite C chronique. Dans l’ordre, 44 (24%) avec Gilead Sciences, 44 (24%) avec MSD, 34 (19%) avec Janssen-Cilag, 17 (9%) avec BMS, 15 (8%) avec Roche et 9 (5%) avec Abbvie.
Pour les 23 médecins du service d’hépatologie de l’hôpital Beaujon ayant signé des conventions, celles-ci se répartissent sur un éventail plus large de firmes pharmaceutiques et de prestataires des firmes. En effet, les 6 groupes pharmaceutiques assurant la promotion des antiviraux ne concentrent plus que 65% des conventions. Dans le détail, 47 (18%) avec MSD, 34 (15%) avec Janssen-Cilag, 33 (13%) avec Gilead Sciences, 26 (10%) avec Roche, 12 (5%) avec BMS et 10 (4%) avec Abbvie.
Nous ne pouvons que regretter une nouvelle fois que les montants de ces conventions soient occultés. Cependant, et suite aux décisions récentes du Conseil d’Etat prises en réponse à deux requêtes du Formindep et du Conseil National de l’Ordre des Médecins, puis après amendement gouvernemental adopté en séance publique le 10 avril 2015 sur l’article 43 bis du projet de Loi de Modernisation du Système de Santé (voir la vidéo : ici, cliquer à droite sur “Après l’article 43” pour vous positionner avant la présentation des amendements par la Ministre), cette lacune pourrait être comblée prochainement (Plus d’infos ici, voir également l’article « Médecins : leurs liaisons dangereuses bientôt mises à nu » de Clotilde CADU, de l’hebdomadaire Marianne ici).
Parmi les conventions signées entre des médecins du service d’hépatologie de l’hôpital Beaujon avec une dizaine d’agences de publicité, de communication ou des sociétés d’études marketing, signalons :
- ALL GLOBAL,
- A+A,
- ARSENAL CDM, qui a comme client notamment Abbvie et Gilead (ici),
- Groupe CEGEDIM (Icomed, Medexact),
- EDITION DE L’INTERLIGNE, éditeur notamment de Décision Stratégie Santé, qui a largement ouvert ses colonnes au sofosbuvir et à Gilead (exemples de recherche dans Google : ici et là),
- Interview Partners France, l’hépatite C, la cirrhose, font partie des domaines d’expertise de l’agence d’étude de marché,
- M3 Global Research Ltd
- Pascaleo, parmi les références client de l’agence d’étude de marché, nous retrouvons Gilead Sciences et MSD France,
- RE-IMAGINE HEALTH AGENCY,
- VIVACTIS M2 RESEARCH, qui cite comme référence les hépatites B et C en hépato-gastroentérologie, avec Abbvie, Roche, Janssen, et l’inévitable Gilead comme clients (ici)
A noter que répondre à une enquête pour un médecin spécialiste, même si l’avantage perçu est modeste (24 à 29 € pour Icomed) peut être valorisant et renforcer le lien avec le laboratoire ou son médicament, surtout si les résultats de l’enquête font l’objet d’une communication au niveau national…
Nous avons individualisé dans le tableau Excel la firme Gilead Sciences, car c’est la grande gagnante en 2014 et en ce début 2015, avec près d’un milliard d’euros de chiffre d’affaire 2014 sur le SOVALDI®, et la 1èreAMM accordée à une association fixe de 2 antiviraux à action directe, HARVONI®, à un prix qui crée une position de quasi monopole (voir les vidéos d’intervention et les documents produits lors de la conférence-débat organisée par Prescrire pour la Pilule d’Or le 29 janvier 2015, en accès libre sur le site de la revue : ici). Cependant, la vidéo de l’APHC postée en 2013 sur Youtube, atteste d’une large utilisation à l’époque de trithérapies interféron + ribavirine + une des 2 antiprotéases alors commercialisées (VICTRELIS®, bocéprévir ou INCIVO®, télaprévir).
A noter pour les associations de professionnels de santé et d’usagers :
- L’APHC, association pour l’amélioration de la prise en charge des hépatites chroniques, nous retrouvons 6 conventions et aucun avantage perçu. 4 conventions ont pour objet « Recherche et développement » avec la firme Bristol-Myers Squibb (12/2013, 02/2014 et 09/2014), 1 avec Boehringer Ingelheim « Recherche avenant » (10/2013), et 1 avec MSD France « Recherche biomédicale » pour la période « du 13/06/2014 au 31/12/2015). Aucune convention sur la période n’a été signée entre l’APHC et la firme Gilead Sciences.
- Pour SOS HEPATITES, association de patients dont le Dr Pascal MÉLIN est le Vice-président chargé des questions médicales, nous trouvons des enregistrements sous 9 dénominations différentes dans la base de données Transparence.sante.gouv.fr. Au total, 24.420 € d’avantages perçus (dont 3 dons de la firme Roche SAS, pour un montant de 22.800 €) et 8 conventions passées avec 5 firmes (Bayer HealthCare SAS, Bouchara – Recordati, Reckitt Benckiser Pharmaceuticals France, Janssen-Cilag, Roche SAS), aucune avec Gilead Sciences sur les 3 dernières années.
Juste un « hic », la base de données Transparence.sante.gouv.fr pourrait être largement incomplète, puisque sur le site de la HAS les données de l’année 2013 (tableau Excel téléchargeable ici) indiquent 114.000 € reçus de la firme Roche par SOS HEPATITES, et 22.000 euros reçus de Gilead Sciences. Et pour l’année 2012 (la HAS n’a pas encore publié les chiffres 2014), l’association avait reçu 346.000 € de subventions, se répartissant en 120.000 € de la part de Janssen-Cilag, 75.000 € de Gilead Sciences, 73.000 € de Roche, 68.000 € de MSD et 10.000 € de BMS (données téléchargeable ici).
La HAS voudrait bien se débarrasser de ce travail ingrat. Cependant, il semblerait nécessaire de s’assurer au préalable que les gestionnaires du site transparence au ministère soient bien en capacité d’assurer le relais sans perte de données. Nous pouvons avoir quelques inquiétudes compte tenu des anomalies et bugs rencontrés que nous allons aborder un peu plus loin.
Les avantages perçus et conventions signées par les principaux protagonistes du « rapport DHUMEAUX »
Le rapport ministériel de « recommandations 2014 pour la prise en charge des personnes infectées par les virus de l’hépatite B ou de l’hépatite C » réalisé sous la direction du Pr Daniel DHUMEAUX, et sous l’égide de l’ANRS et de l’AFEF, a pesé lourdement sur l’évaluation par la HAS des nouveaux médicaments du traitement de l’hépatite C chronique ainsi que sur l’élargissement des indications de traitement avec ces médicaments par les hépatologues.
En effet, il est possible de lire dès la première page de l’avis de la commission de la transparence de la HAS en date du 14 mai 2014 portant sur le SOVALDI® : « Selon le rapport DHUMEAUX, il est recommandé de proposer le traitement par sofosbuvir en priorité à tous les patients ayant un score de fibrose ≥ F2 ainsi qu’à certaines populations particulières, indépendamment du degré de fibrose : patients ayant des manifestations extra-hépatiques du virus de l’hépatite C, patients en attente de transplantation d’organe, femmes ayant un désir de grossesse, usagers de drogues et personnes détenues. ».. Ce rapport était alors « à paraître » le 19 mai 2014 et les membres de la commission avaient pu en prendre connaissance le 5 mai 2014.
Malheureusement, le rapport DHUMEAUX est entaché d’une gestion défaillante des liens et conflits d’intérêts, car de nombreux protagonistes de ces recommandations, dont ceux qui en avaient officiellement reçu la charge, possèdent des liens d’intérêts majeurs. En effet, si l’on se réfère au « Guide des déclarations d’intérêts et de gestion des conflits d’intérêts » élaboré par la HAS en 2013 (ici), l’intensité des liens d’intérêts, et des conflits d’intérêts qui en découleraient, tient à la fréquence des relations ayant construit ces liens, au montant des avantages financiers, à l’ancienneté et à la permanence de ces liens. En terme d’activité, la participation à l’instance décisionnelle d’une entreprise qui fabrique ou commercialise un produit ou service en cours d’évaluation, est considérée bien évidement comme un lien d’intérêt majeur par la HAS. C’est une révélation que nous faisons ici, car il semble que cela n’ait gêné personne jusqu’à présent.
En effet, n’est-il pas très troublant, alors que le rapport ait été commandé en janvier 2013 par la Ministre Marisol TOURAINE, et livré fin mai 2014, d’apprendre que le Pr Daniel DHUMEAUX ait perçu des avantages en novembre 2013 (pour un montant de 3.000 euros de la part de GILEAD SCIENCES) voir les captures d’écran ci-dessous :
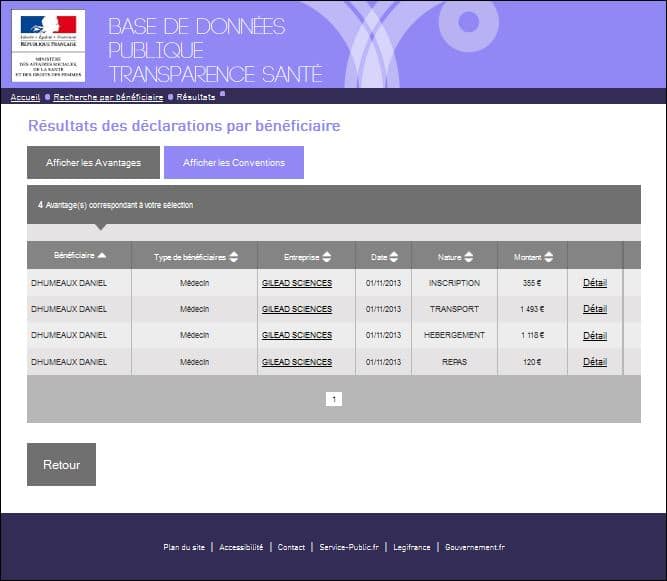
Les avantages perçus par le Pr Daniel DHUMEAUX en pleine élaboration des recommandations qu’il dirigeait

Les conventions signées avec les firmes par le Pr Daniel DHUMEAUX en pleine élaboration des recommandations qu’ils dirigeait
Et ce n’est pas tout. Voilà ce qu’a trouvé aussi un membre de l’association FORMINDEP comme dpi (déclaration publique d’intérêt) pour le Pr DHUMEAUX :
En septembre 2013, « le Pr DHUMEAUX, ne déclare pas de lien d’intérêts », dans l’interview accordé au LIR (association des laboratoires internationaux de recherche, qui regroupe 16 firmes pharmaceutiques, dont celles qui produisent les antiviraux de l’hépatite C, à la seule exception notable de Gilead Sciences) : ici,
Mais en septembre 2014, il déclare des liens d’intérêts portant sur les années 2010-2013 : ici, dans le détail, des prises en charges dans les congrès internationaux suivants :
- EASL 2010, Vienne, Autriche (Novartis),
- AASLD 2011, San Francisco, USA (Roche),
- AASLD 2012, Boston, USA (Roche),
- EASL 2012, Barcelone, Espagne (Janssen),
- AASLD 2013, Washington, USA (Gilead Sciences)
Le Pr DHUMEAUX était également en 2011 Président de l’EASL, financée par les firmes Gilead Sciences, BMS, Abbvie (voir au bas de la page : ici)
Certaines recommandations HAS ont été par le passé invalidées pour moins que cela (voir ici l’exemple de la recommandation HAS 2006 portant sur la prise en charge du diabète de type 2, abrogée par le Conseil d’Etat, et là le retrait par la HAS de sa recommandation 2008 portant sur la maladie d’Alzheimer)…
Il faut savoir aussi que l’agence de recherche ANRS et la société savante AFEF, sous l’égide desquelles le rapport DHUMEAUX a été élaboré, sont toutes deux très liées aux firmes pour leur financement :
L’ANRS, agence nationale de recherche sur le sida et l’hépatite virale, agence autonome de l’INSERM, collabore contractuellement avec les industriels. Nous retrouvons sur le site transparence santé du Ministère, un « don de fonctionnement » pour le bureau de l’ANRS d’un montant de 14.999 € octroyés par la firme MSD France en novembre 2013, et une convention (non chiffrée bien évidemment) signée avec Janssen-Cilag pour une prestation de « Recherche » sur la période du 15/01/2014 au 31/05/2014. L’ANRS étant promoteur d’essais thérapeutiques, il est clair que de nombreux contrats ne sont pas déclarés sur le site Transparence santé (voir « Une collaboration contractuelle avec les industriels » au bas de la page : ici). L’agence dirigée par le Pr Jean-François DELFRAISSY (le « pape » des médicaments antiVIH), a un budget annuel d’environ 50 millions d’euros (ici).
L’AFEF, association française pour l’étude du Foie, est une société savante, dont les « partenaires » sont Gilead Sciences, Janssen-Cilag et Abbvie…

Pas moins de 4 conventions entres des firmes commercialisant des antiviraux de l’hépatite C et l’ANRS « chevauchent » la période d’élaboration des recommandations DHUMEAUX : Avec Janssen-Cilag, deux contrats de « Partenariat » du 06/07/2013 au 31/12/2013 et du 25/03/2014 au 27/09/2014 ; Avec Roche, un contrat de « parrainage » du 30/10/2013 au 30/11/2014 ; Avec Gilead Sciences, un contrat « Autres » signé le 10/04/2014.
Mais il y a beaucoup plus grave. En consultant le site Transparence santé, nous apprenons que le Pr DELFRAISSY a participé à une réunion du « board » de Gilead Sciences le 18 décembre 2013. Il faut savoir que c’est au Directeur de l’ANRS que Madame la Ministre avait par lettre du 25 janvier 2013 commandé le rapport d’expertise sur les hépatites, et que l’ANRS a confié à l’AFEF le soins de composer le groupe chargé de l’élaboration des recommandations…
Ne soyons donc pas surpris de retrouver pour le groupe de travail 9. « Conséquences cliniques et traitement de l’infection par le virus de l’hépatite C » : Le Pr Patrick MARCELLIN, Coordinateur, et parmi les 21 membres, Tarik ASSELAH, Marc BOURLIÈRE, Nathalie BOYER, Béatrice MONNIER… A noter que le Pr Patrick MARCELLIN est le 2ème auteur de l’étude QUEST2 avec le siméprivir, publiée dans le Lancet en août 2014 (ici).
C’est à ce groupe que suite à l’arrivée sur le marché du sofosbuvir, nous devons les recommandations suivantes du rapport DHUMEAUX (page 252) :
- Poursuivre un objectif d’éradication du virus (critère intermédiaire),
- Décider du traitement antiviral dès le stade 2 de la fibrose modérée,
Et cela, en s’étant appuyé sur seulement trois références bibliographiques démontrant un bénéfice de morbi-mortalité essentiellement chez des patients à un stade bien plus avancé de fibrose et tous traités par de vieux médicaments, l’interféron, seul ou associé à la ribavirine…
A noter pages 175 du rapport DHUMEAUX, à propos du stade 2 de fibrose modérée, le groupe de travail 7. « Évaluation de la fibrose hépatique chez les patients atteints d’hépatites B et C » précisait que : « Ce critère de traitement a été retenu pour l’hépatite C à l’époque où le traitement reposait sur la bithérapie pégylée associée à de nombreux effets indésirables et à une efficacité inconstante. On ne peut exclure que la disponibilité de traitements mieux tolérés et plus efficaces puissent diminuer la pertinence de cette cible diagnostique ». Soulignons la disponibilité de nouvelles techniques de mesures non invasives de la fibrose hépatique : tests sanguins, élastométrie (FibroScan®, Echosens) et élastographie (Echographie abdominale). Les deux premières ayant été validées par la HAS en 2008 et remboursées par l’assurance maladie depuis 2012. Elles permettent une surveillance une fois par an. L’élastométrie est très performante pour exclure le diagnostic de cirrhose (risque de faux négatif inférieur à 10%) et son association aux tests sanguins augmente la performance diagnostique pour la fibrose significative. Il serait donc assez simple d’identifier avec suffisamment de précision les stades F3 et de traiter à ce stade… Ce groupe de travail pointe aussi la difficulté de discriminer entre les stades F1 et F2 avec les techniques non invasives. Ses conclusions omettent néanmoins de mentionner le risque de surdiagnostic et donc de surtraitement qui pourrait découler de cette observation.
Cette idée empreinte de bon sens, n’a eu aucun impact sur les recommandations finales du rapport DHUMEAUX impulsées par le groupe 9, qui ont largement ouvert les indications du sofosbuvir. Il est vrai que le groupe de travail sur la fibrose était coordonné par le Pr Vincent LEROY, PU-PH en Gastroentérologie au CHU Grenoble (et également membre du groupe 9). Nous trouvons pour cet expert sous influence 78 avantages perçus et 64 conventions, dont une réunion au « board » de Gilead Sciences le 9 décembre 2013 (pendant l’élaboration du rapport), une autre le 26 mai 2014 (juste après la sortie du rapport « DHUMEAUX » et la réunion de la commission de la transparence qui avait validé l’ASMR II (progrès « important ») votée le 4 avril pour SOVALDI®, encore une autre le 18 décembre 2014 (un mois après le dénouement heureux de la négociation du prix du sofosbuvir avec la CEPS, cf. infra).
La question cruciale est de savoir à partir de quel stade de fibrose (F2 : modérée ; F3 : sévère ; F4 : cirrhose) il est nécessaire de traiter dans l’hépatite C chronique avec les nouveaux antiviraux à action directe. C’est une question à plusieurs centaines de millions d’euros pour l’assurance maladie. Pour autant, il est bien difficile de trouver une estimation de la répartition des nombres de patients par stade de fibrose. Le rapport « DHUMEAUX », qui déplore l’absence d’actualisation des données épidémiologiques depuis 2004, mentionne (page 45) : « Environ 200.000 personnes étaient porteuse chronique du VHC fin 2013, dont 43% au stade de fibrose F0-F1, 49% au stade F2-F4, et 8% au stade de complication (cirrhose décompensée ou carcinome hépatocellulaire) » et renvoie à un travail de « modélisation épidémiologique » publié dans Gastroenterology en octobre 2012 (« full-text » en accès libre ici).
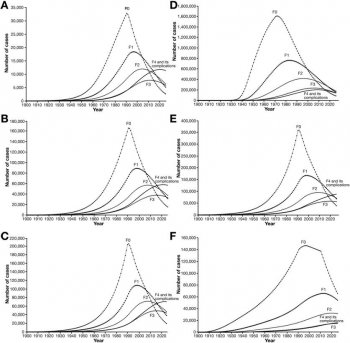
Répartition des stades histologiques de fibroses en l’absence de traitement (histoire naturelle de l’hépatite C chronique) chez des patients présentant une hépatite C chronique dans chacune des pays suivants : Belgique (A), France (B), Allemagne (C), Italie (D), Espagne (E), Royaume Uni (F). Source : travail précité publié dans Gastroenterology.
Nous voyons bien que le stade F2 représente plus du tiers du total « F2-F4 », soit probablement 35.000 patients en France, ce qui représente près de 1,5 milliards d’euros de dépenses pour l’assurance maladie (en valorisant uniquement le SOVALDI® au prix négocié par le CEPS, Cf. infra).
Au final, outre les professeurs Jean-François DELFRAISSY et Vincent LEROY, les membres de l’équipe du Pr MARCELLIN, du service hépatologie de Beaujon qui ont participé aux groupes 7 et 9 du rapport DHUMEAUX et ont été à des réunion de « board » de GILEAD, sont (cf Fichier EXCEL plus haut) : Nathalie BOYER (2 réunions au “board” de GILEAD sur la période du rapport + 1 autre après), Tarik ASSELAH (1 réunion en 12/2013, une autre juste après la publication du rapport le 26/05/2014), mais aussi Patrick MARCELLIN en personne, le 12/05/2014 (moment clef, juste avant la réunion de la commission de la transparence statuant sur les antiviraux dont le sofosbuvir ! Marc BOURLIERE aussi (4 pendant : 16/10/2013, 20/12/2013, 19/03/2014, 12/05/2014, 3 après : 28/05/2014, 17/12/2014, 18/12/2014…)
Fort de ce constat accablant, je décide de pousser un peu plus loin mes investigations sur l’ensemble des membres du groupe 9. En voici le résultat :
A l’exception notable du Dr Cédrick MOREAU, Paris, qui n’avait pas de lien avec les firmes commercialisant des antiviraux dirigés contre le virus de l’hépatite C (mais en possède avec RB Pharmaceuticals qui commercialise en France des médicaments permettant de lutter contre l’addiction aux opiacés), la totalité des professionnels de santé du groupe 9 entretiennent ce type de lien avec les firmes qui évoluent sur le marché de l’hépatite C chronique. Parmi ces 20 experts, pas moins de 12 (en gras ci-après) ont participé aux réunions du « board » de GILEAD Sciences pendant la période d’élaboration des recommandations :
- Patrick MARCELLIN, Hôpital Beaujon, Clichy, 37 conventions, dont 1 réunion au « board » de GILEAD le 12/05/2014, et 30 avantages,
- Tarik ASSELAH, Hôpital Beaujon, Clichy, 48 conventions, dont 2 réunions au « board » de GILEAD 09/12/2013, 26/05/2014, et 49 avantages,
- Marc BOURLIERE, Hôpital Saint-Joseph, Marseille, 58 conventions, dont 7 réunions au « board » de GILEAD les 16/10/2013, 20/12/2013, 19/03/2014, 12/05/2014, 28/05/2014, 17/12/2014, 18/12/2014, et 76 avantages,
- Nathalie BOYER, Hôpital Beaujon, Clichy, 26 conventions, dont 3 réunions au « board » de GILEAD les 16/10/2013, 19/03/2014, 01/10/2014, 51 avantages,
- Jean-Pierre BRONOWIKI, CHU NANCY, 54 conventions (dont 3 réunions médicales avec GILEAD, les 20 et 21/06/2014, 16/12/2014, et aussi des conventions avec MSD, JANSSEN, ABBVIE, ROCHE, BRISTOL-MYERS SQUIBB), 77 avantages perçus,
- Jean-François CADRANEL, CH CREIL, 33 conventions, dont 3 réunions au « board » de GILEAD les 26/11/2013, 12/05/2014, 18/12/2014, 37 avantages,
- Laurent CATTAN, Paris, 7 convention (JANSSEN, MSD), 10 avantages,
- Gilles DUVERLIE, Université de Picardie-Jules Verne, Amiens, 2 conventions (« ViiV HEALTHCARE SAS »), 2 avantages (dont un repas offert par GILEAD le 26/03/2014,
- Thierry FONTANGES, CH Bourgoin-Jallieu, 41 conventions (MSD, JANSSEN, ROCHE, ABBVIE, BRISTOL-MYERS SQUIBB, GILEAD), et 93 avantages,
- Christophe HÉZODE, Henri Mondor, Créteil, 68 conventions, dont 2 réunions au « board » de GILEAD les 30/10/2013, 12/05/2014, et 52 avantages,
- Florence LACAILLE, Hôpital Necker-Enfants malades, Paris, 22 conventions (MSD, ABBVIE), et 61 avantages,
- Victor de LÉDINGHEN, Hôpital Haut-Lévêque, Pessac, 52 conventions, dont 3 réunions au « board » de GILEAD les 26/11/2013, 12/05/2014, 18/12/2014, et 104 avantages,
- Vincent LEROY, CHU Grenoble, 64 conventions, dont 3 réunions au « board » de GILEAD les 09/12/2013, 26/05/2014, 24/11/2014, et 78 avantages,
- Vincent DI MARTINO, CHU Besançon, 28 conventions, dont 2 réunions au « board » de GILEAD les 09/12/2013, 18/12/2014, et 78 avantages,
- Béatrice MONNIER, Hôpital Beaujon, Paris, 3 conventions (MSD, ROCHE), 6 avantages,
- Albert TRAN, CHU Nice, 44 conventions, dont 3 réunions au « board » de GILEAD les 09/12/2013, 21/05/2014, 10/12/2014, et 86 avantages,
- Christian TRÉPO, HCL, Lyon, 6 conventions avec JANSSEN, ABBVIE, ROCHE, et l’Edition de l’Interligne (« Board »), 27 avantages (dont GILEAD),
- Yazdan YAZDANPANAH, Hôpital Bichat-Claude-Bernard, Paris, 71 conventions, dont 7 réunions au « board » de GILEAD les 08/07/2013, 11/07/2013, 18/12/2013, 02/03/2014, 19/03/2014, 03/09/2014, 12/12/2014, 59 avantages perçus,
- Jean-Pierre ZARSKI, CHU Grenoble, 36 conventions, dont 2 réunions au « board » de GILEAD les 26/11/2013, 12/05/2014, 91 avantages perçus, de nombreux provenant de GILEAD,
Et encore, et encore, dans le groupe 7 nous trouvons aussi le Dr Pierre BEDOSSA, anatomo-pathologiste de l’hôpital Beaujon, qui possède aussi des liens conséquents avec GILEAD, même s’il n’a pas été au « board ».
Les conflits d’intérêts des membres du groupe 7, globalement sont moins importants que pour le groupe 9, néanmoins quelques uns sont à prendre en compte :
- Laurent CASTÉRA, Hôpital Beaujon (service hépatologie), Clichy, 5 conventions, dont 2 avec GILEAD (réunion « professionnelle » le 19/12/2013, réunion « médicale » les 16 et 17/10/2014, et une pour des prestations d’orateur pour Echosens, le fabricant de FibroScan®, 11 avantages, dont 3 déjeuners avec GILEAD pendant l’élaboration des recommandations (19/12/2013, 04/02/2014 et 18/03/2014), ainsi qu’une « hospitalité » offerte par Echosens, pour un montant de 4.610 € (?) le 25/04/2014.
- Philippe HALFON, Infectiologue, Laboratoire Alphabio, Hôpital Européen, Marseille, 17 conventions, 33 avantages,
- Karine LACOMBE, Hôpital St-Antoine, Paris, 48 conventions, dont 5 réunions au « board » de GILEAD, les 20/11/2013, 20/12/2013, 18/04/2014, 05/12/2014, 17/12/2014, 52 avantages,
- Victor de LÉDINGHEN, Hôpital Haut-Lévêque, Pessac (appartenant aussi au groupe 9), 52 conventions, dont 3 réunions au « board » de GILEAD les 26/11/2013, 12/05/2014, 18/12/2014, et 104 avantages,
- Ariane MALLAT, Hôpital Henri Mondor, Créteil, 6 conventions, dont une réunion « médicale » avec GILEAD, les 16 & 17/10/2014, 21 avantages, dont une prise en charge par GILEAD à hauteur de 931 € (hébergement, inscription, transport) le 02/10/2013,
- Julien VERGNIOL, CHU Bordeaux, Pessac, 11 conventions, dont Echosens le 15/09/2012, JANSSEN en avril, octobre et novembre 2013, ABBVIE en avril 2014, 56 avantages, dont GILEAD, dont 7 repas offerts par GILEAD (22/05/2014, 23/10/2014, 08/07/2013, 02/12/2013, 16/04/2014, 18/04/2014, 23/05/2014),
- Pascal LEBRAY, Hôpital Pitié-Salpétrière, Paris, 29 conventions, dont une réunion « professionnelle » le 31/01/2014 avec GILEAD, 2 autres les 9 et 10/12/2014, 34 avantages perçus, dont 3 repas avec GILEAD les 10/09/2013, 02/12/2014, 02/12/2013, et 1.236 € d’hébergement, transport et repas les 2 et 4 juin 2014.
Songez que les professeurs DELFRAISSY, PAGEAUX et DE LÉDINGHEN ont eu le toupet de rappeler dans la préface du rapport « DHUMEAUX » la volonté de la Ministre pour l’élaboration de ces recommandations « en respectant les principes d’impartialité, de transparence, de pluralité et du contradictoire ».
Georges-Philippe PAGEAUX, ancien secrétaire de l’AFEF (remplacé par Victor DE LÉDINGHEN), hépatologue au CHU de Montpellier, a pour sa part signé 37 conventions avec les laboratoires, dont une présence au « board » de GILEAD les 20/12/2013, 12/05/2014, des réunions « professionnelles » ou « médicales » pour la même firme les 5 et 17/12/2013, 28 et 29/03/2014, 02/12/2014, et 45 avantages perçus
Bref, arrêtons nous là. Nous ne pouvons quand même pas vérifier les liens d’intérêts des 20 autres groupes de travail du rapport DHUMEAUX. La concentration des experts les plus liés à Gilead au sein de ce groupe chargé de la tâche stratégique de définir les patients éligibles, et donc la taille du marché de SOVALDI®, interroge.
Avec un tel défilé d’experts aux “boards” de GILEAD Sciences, n’est-il pas légitime que la Ministre suspende le rapport DHUMEAUX, que la HAS (agence indépendante) demande le ré-examen par la Commission de la transparence de l’ensemble des antiviraux à action directe et se penche à nouveau sur la cible des patients à traiter ?
Et finalement, où se situe l’articulation entre l’expertise sous influence et la décision publique, laquelle est du ressort du politique ?
Une réponse à cette question lancinante peut être apportée par les « 2ème rencontres parlementaires sur l’hépatite C » (ici), qui se tinrent le 27 mai 2014, à un moment éminemment stratégique (juste après la réunion de la commission de la transparence qui a accordé une ASMR « importante » bien généreuse pour un bénéfice portant sur un critère subrogé au meilleur critère de jugement, à savoir la survie en bonne ou en meilleure santé, et a validé sans la discuter la population cible des patients à traiter telle qu’imposée par le rapport DHUMEAUX). Se côtoyaient alors nos experts en hépatologie ou virologie (DELFRAISSY, DHUMEAUX, MARCELLIN,…), le Directeur Général de la Santé (Pr Benoît VALLET, Cf. infra), notre représentation nationale (BAPT, BOYER*, DOOR, JACQUAT**, ROBINET, TOURAINE**, qui n’est pas dénuée de liens…).
Les experts ayant participé à ces rencontres parlementaires, mais pas aux travaux des groupes de travail 7 et 9, ont également des conflits d’intérêts majeurs avec les firmes, et ne sont pas non plus là par hasard :
- André-Jean REMY, CH Perpignan, 71 conventions, dont une réunion au « board » de GILEAD la 09/10/2014, et 120 avantages perçus, dont 13.117 € payés par GILEAD en hébergement, inscription, transport et repas entre octobre 2013 et novembre 2014,
- Jean-Michel PAWLOTSKY, GH Henri Mondor, Créteil, Directeur du centre national de référence des hépatites virales B, C et delta, représentant de la société française de microbiologie, 32 conventions, dont 4 réunions « professionnelles » (les 19/09/2013, 28 & 29/03/2014) ou « médicales » (les 27/11/2014 et 04/12/2014) avec GILEAD, 29 avantages perçus, dont 1.413 € réglés par GILEAD,
Quant à Sylvie DEUFFIC-BURBAN, INSERM, Loos et Faculté de Médecine de Lille, membre du groupe de travail N°7, et participante aux rencontres parlementaires, elle a été prise en charge par ABBVIE pour sa participation en avril 2014 au congrès européen EASL de Londres pour un montant de 1.071 €
A la question « Pensez-vous pouvoir être rémunéré comme orateur par l’industrie pharmaceutique ou accepter l’invitation de l’un de leurs représentants sans que votre prescription soit influencée ? », 51% des médecins spécialistes français répondent par l’affirmative, selon les résultats d’un sondage publié par Medscape France le 17 avril 2015 (ici).
Décidément, l’hépatologie a repoussé bien loin les limites de son expertise en … dissonance cognitive.
* : Valérie BOYER (2 repas avec JANSSEN, pour un infirmier à Marseille)
** : Denis JACQUAT (convention et avantages perçus de SANOFI, PFIZER, dont une inscription financée par SANOFI)
*** : Pr Jean-Louis TOURAINE, député du Rhônes (1 convention d’hospitalité et 2 repas offerts par ABBVIE en novembre 2013)
Epilogue : L’après « Rapport DHUMEAUX »
Trois arrêtés de la Ministre en charge de la Santé (30/10/2014, 29/04/2015, et 15/05/2015) sont venus récemment préciser les indications prises en charge par l’assurance maladie en ville et à l’hôpital pour les nouveaux antiviraux à action directe contre le virus de l’hépatite C, sofosbuvir, daclatasvir, siméprévir et association lédipasvir/sofosbuvir ;
Parmi les indications prises en charge nous avons la surprise de trouver « le traitement, en association avec d’autres médicaments, de l’infection chronique par le virus de l’hépatite C chez l’adulte de génotype 1, 3 ou 4, présentant un stade de fibrose hépatique F2 sévère ».
Ni le rapport DHUMEAUX, ni la recommandation du collège de la HAS « Prise en charge de l’hépatite C par les médicaments anti-viraux à action directe (AAD) – juin 2014 » adoptée par décision du collège le 25 juin 2014, ni les avis de la commission de la transparence, ne mentionnent ce stade d’évolution de la fibrose hépatique qui ne correspond pas non plus aux libellés des indications (moins restrictives) de l’AMM (Ces arrêtés figurent dans les bases de données médicamenteuses à la rubrique « Renseignements administratifs », qui a peu de chance d’être consultée par les prescripteurs).
Rappelons, que la nosologie exposée dans le rapport DHUMEAUX définie les stades F2, pour « fibrose modérées », F3, pour « fibrose sévère » et F4 pour « cirrhose »
Qu’est-ce qu’une « fibrose modérée sévère » ?
Après tout, peut-être s’agit-il d’une erreur dans la rédaction des arrêtés.
Une recherche dans le moteur Google avec les mots clés « fibrose F2 sévère » renvoie aux résultats suivants (ici)
Nous retrouvons effectivement ce stade de fibrose « F2 sévère » dans un avis d’experts de l’AFEF « Traitement de l’hépatite C » datant du 4 décembre 2014 (téléchargeable ici) qui n’apporte pas non plus de définition de ce « nouveau » stade de la fibrose et se borne à préciser que seul le sofosbuvir était à ce moment-là pris en charge dans cette « indication » (arrêté du 30/10/2014 susmentionné, publié au JO le 04/11/2014).
Parmi les experts, nous retrouvons bien évidemment quelques connaissances.
On retrouve aussi une présentation plus ancienne de Victor de LÉDINGHEN en ligne sur le site APHC (ici) qui mentionne un avis d’expert « Evaluation de la sévérité de la maladie hépatique pour initier un traitement dans l’hépatite C » daté de septembre 2014… Cet avis d’expert est accessible sur le site « hepatoweb » ici.
Y aurait-il connivence entre la DGS (Madame Catherine CHOMA), qui signe pour la Ministre ces arrêtés, les experts de l’AFEF et les firmes ?
Signalons en passant que le Directeur Général de la Santé lui-même, le Pr Benoît VALLET, mentionne dans la déclaration publique d’intérêt qu’il a rempli le 8 avril 2015 en tant que membre de Comité Économique des Produits de Santé (CEPS), que l’un de ses proches parents est salarié ou possède des intérêts financiers chez GILEAD Sciences (document téléchargeable ici).
Voilà qui pourrait expliquer pourquoi les défilés aux « board » de GILEAD Sciences se sont poursuivis bien au-delà de la publication en mai 2014 du rapport DHUMEAUX :
- Marc BOURLIÈRE (17 & 18/12/2014),
- Victor de LÉDINGHEN (18/12/2014),
- Vincent LEROY (24/11/2014),
- Albert TRAN (10/12/2014),
- Dominique LARREY, CHU Montpellier (« nouveau », 93 conventions + 128 avantages + « board » chez GILEAD Sciences le 10/12/2014… + Board chez EDITION DE L’INTERLIGNE le 09/07/2014 + « réunions professionnels » pour ou chez GILEAD Sciences les : 19/09/2014, 28/10/2014, 02/12/2014),
- Stanislas POL, Hôpital Cochin, AP-HP (« nouveau », 93 conventions + 95 avantages + 4 réunions de « board » chez GILEAD Sciences les 26/11/2013, 19/03/2014, 12/05/2014, 12/12/2014),
- Lawrence SERFATY, Hôpital Saint-Antoine, AP-HP (« nouveau », 64 conventions + 86 avantages + 4 réunions de « board » chez GILEAD Sciences les 04/12/2013, 12/05/2014, 02/07/2014, 18/12/2014), et
- Fabien ZOULIM, Hospices Civils de Lyon (« nouveau », 35 conventions + 75 avantages + « board » chez GILEAD Sciences le 26/11/2013)
La DGS a-t-elle souhaité timidement et bien tardivement freiner les ardeurs de l’AFEF :
En effet, nous retrouvons en poussant nos recherches une lettre d’instruction de la DGS datée du 30 avril 2015, téléchargeable à la fois sur le site de l’AFEF (ici) et sur la page du site du Ministère consacrée à l’hépatite C (là), mais introuvable sur le site officiel des circulaires et lettres d’instruction des ministères (ici).
Page 4, un paragraphe esquisse une définition de la « fibrose modérée sévère » (ou plutôt « les stades les plus sévère de la fibrose modérée ») :
« Les stades de fibrose les plus sévères sont appréciés au cas par cas dans le cadre de la RCP (réunion de concertation pluridisciplinaire*), et définis à l’issue de celle-ci, sur la base, d’une part de l’état clinique du patient et, d’autre part, sur les résultats des tests non-invasifs, dont les résultats à deux reprises, concordent pour prédire une évolutivité de la fibrose hépatique »
(*) Un modèle de fiche RCP, ainsi qu’une fiche d’organisation de RCP hépatite C, figurent sur le site de l’AFEF : ici)
Cette lettre d’instruction adressée « pour diffusion » aux ARS, et « pour mise en œuvre » aux directeurs d’établissements de santé et des caisses d’assurance maladie, est bien tardive puisque publiée six mois jour pour jour après l’arrêté du 30 octobre fixant des indications prises en charge par la sécurité sociale.
Ce sentiment que les autorités de santé ont tenté de résister au désir ardent de l’AFEF de traiter tous les malades ou presque, était lisible à la lecture des recommandations du collège de la HAS de juin 2014 (ici) :
« La Commission a considéré que l’impact supplémentaire, par rapport aux inhibiteurs de protéase sur la morbi-mortalité (évolution vers la chronicité, fibrose, hépato-carcinome et décès) des patients traités, suggéré par une modélisation, était à prendre avec circonspection. Elle a aussi souligné le caractère limité des données chez les patients cirrhotiques ainsi que chez les patients non répondeurs à l’interféron, en particulier ceux de génotype 1 pré- traités qui n’ont pas été inclus dans les études. »
« La Commission de la transparence, bien qu’elle ne disposait pas de données d’efficacité selon le stade de fibrose, mais prenant en considération les recommandations existantes, s’est prononcée sur le bien-fondé d’une stratégie thérapeutique reposant sur les stades de fibrose hépatique. »
« Au regard des données transmises par l’industriel, l’efficacité et l’efficience du sofosbuvir dans chacune des sous populations de patients selon le stade de fibrose n’ont pas pu être établies par les deux commissions. »
« Les essais thérapeutiques n’ont permis de démontrer qu’une efficacité sur la réplication virale selon les génotypes étudiés, sans démonstration d’un effet sur la prévention de la fibrose hépatique, de la cirrhose ou de la survenue d’un cancer hépatique. Ces essais n’avaient pas vocation à définir la stratégie thérapeutique à employer pour les patients infectés. »
Pour connaitre la suite, il suffisait de lire l’article du Quotidien du Médecin daté du 29 mai 2015 et intitulé « Hépatite C : l’AFEF s’engage pour une éradication en 10 ans et élargit ses indications de traitement » (en accès libre : ici).
Il nous apprend que :
- L’AFEF a outrepassé les recommandations européennes et propose d’abandonner l’interféron en 1èreintention, pour le remplacer par les nouveaux antiviraux « beaucoup plus efficaces »,
Mais, elle oublie de signaler que l’interféron associé ou non à la ribavirine et le seul médicament à avoir démontré une réduction de la morbi-mortalité chez les patients porteurs chroniques de l’hépatite C…
- L’AFEF recommande de traiter tous les patients « quelque soit la sévérité de la fibrose »,
Ces nouvelles recommandations de juin 2015 de l’AFEF viennent d’être mises en ligne ce lundi 1er juin 2015 (ici, 126 pages…), et pour ce qui concerne les options thérapeutiques recommandées, nous retrouvons bien celles rapportées par le Quotidien du Médecin.
Le comité d’experts choisis au sein de l’AFEF est bien évidemment extrêmement lié aux firmes commercialisant des antiviraux à action directe.

Les recommandations de l’AFEF publiée sur son site en juin 2015, nous mentent déjà sur l’absence de liens d’intérêts déclarés pour leurs deux présidents, les Professeurs Olivier CHAZOUILLERES et Patrick HILLON :
- Olivier CHAZOUILLERES, Hôpital Saint-Antoine, AP-HP, Paris, 8 conventions (dont Echosens, MSD, Janssen Cilag) et 37 avantages perçus pour un montant de 8.563 euros (dont BMS : 3.040 €, JANSSEN CILAG : 1.947 €, GILEAD SCIENCES : 640 €),
- Patrick HILLON, CHU Dijon, 13 conventions (dont 4 « réunions médicales » chez GILEAD SCIENCES, les 20/05/2014, 20/06/2014, 16/10/2014 et 16/12/2014) et 54 avantages perçus pour un montant total de 9.558 €, dont MSD : 3.621 €, GILEAD SCIENCES : 3.554 €, JANSSEN CILAG : 538 €)
Parmi les autres membres du « comité scientifique » (page 2), nous connaissons déjà Christophe HÉZODE,Victor de LÉDINGHEN, Georges-Philippe PAGEAUX, Albert TRAN, Fabien ZOULIM. Tous ont participé à des réunions de « board » chez GILEAD SCIENCES.
Mais, qu’en est-il des 4 autres ?
- Hélène FONTAINE, Hôpital Cochin, AP-HP, Paris, 20 conventions (dont au moins 5 réunions « professionnelles » ou « médicales » pour GILEAD Sciences, les 19/09/2013, 30/10/2013, 07/03/2014, 16/09/2014, 09/10/2014, et avec BMS, JANSSEN, MSD) et 39 avantages perçus,
- Bertrand HANSLIK, CHU Montpellier, 42 conventions (dont 4 réunions de « board » et 4 réunions « professionnelles » chez GILEAD SCIENCES les 08/07/2013, 16/10/2013, 19/03/2014, 28/03/2014, 29/03/2014, 01/10/2014, 07/10/2014, 02/12/2014) et 95 avantages perçus,
- Christophe RENOU, CH Hyères, 8 conventions (dont une réunion « médicale » pour GILEAD Sciences le 05/09/2014) et 27 avantages perçus (dont 6.728 € financés par GILEAD SCIENCES),
- Dominique SALMON-CERON, Hôpital Cochin, AP-HP, Paris, 35 conventions (dont 3 réunions au « board » de GILEAD SCIENCES, les 20/12/2013, 28/05/2014, 17/12/2014, et une réunion « médicale » le 30/09/2014) et 97 avantages perçus,
Et qu’en est-il des autres participants à la journée d’élaboration de ces recommandations 2015 ?
De la liste des participants (page 123), nous avons déjà décrit les liens de Lawrence SERFATY, Marc BOURLIERE, Jean-Michel PAWLOTSKY, Jean-Pierre BRONOWIKI, Jean-Pierre ZARSKI, Thierry FONTANGES, Vincent LEROY, Tarik ASSELAH, Stanislas POL et Yazdan YAZDANPANAH. Voici donc ceux des neuf autres participants :
- Dominique GUYADER, CHU Rennes, 37 conventions (dont 3 réunions de « board » chez GILEAD les 04/12/2013, 21/05/2014, 10/12/2014 et 5 réunions « médicales » les 28/03/2014, 29/03/2014, 27/06/2014, 28/06/2014, 04/12/2014) et 56 avantages,
- Dominique THABUT-DAMAIS, Hôpital La Pitié-Salpétrière, AP-HP, Paris, 40 conventions (dont 2 réunions de « board » chez GILEAD Sciences les 09/12/2013, 10/12/2014, et 5 réunions « professionnelles » ou « médicales » les 31/01/2014, 13/03/2014, 28/03/2014, 29/03/2014, 27/11/2014) et 28 avantages,
- Arnaud PAUWELS, CH Gonesse, 7 conventions (dont 6 avec MSD et JANSSEN), 9 avantages (dont 2 repas offerts par GILEAD Sciences en septembre 2013 et juillet 2014),
- François BAILLY, HCL, Lyon, 38 conventions (dont 2 réunions au « board » de GILEAD Sciences, les 09/12/2013, 26/05/2014) et 70 avantages,
- Lionel PIROTH, CHU Dijon, 22 conventions (dont 2 « board » chez GILEAD les 22/12/2013, 17/12/2014 et 2 réunions « médicales » les 09/10/2014, 10/10/2014) et 41 avantages,
- Jean-Charles DUCLOS-VALLÉE, Hôpital Paul Brousse, AP-HP, Villejuif, 13 conventions (dont une réunion de « board » chez GILEAD le 21/05/2014, et 6 réunions « médicales » les 09/10/2013, 10/10/2013, 11/10/2013, 15/05/2014, 19/06/2014, 10/10/2014) et avantages,
- Laurent ALRIC, CHU Toulouse, 27 conventions (dont une réunion « médicale » le 27/05/2014 et un symposium le 12/12/2014 pour GILEAD, 8 prestations d’orateur ou d’expert pour BMS, MSD, 2 congrès / symposium pour JANSSEN) et 56 avantages perçus (dont 1.618 € financés par GILEAD en avril 2014),
- Thierry POYNARD, Hôpital La Pitié-Salpétrière, AP-HP, Paris, 8 conventions (dont 1 réunion « professionnelle » avec GILEAD le 19/12/2013, prestation de « Conseil », « Orateur » et congrès / symposium, pour JANSSEN et MSD) et 7 avantages,
- Philippe MATHURIN, CHU Lille, 53 conventions (dont 8 réunions au « board » de GILEAD, les 16/10/2013, 26/11/2013, 20/12/2013, 19/03/2014, 12/05/2014, 28/05/2014, 01/10/2014, 18/12/2014 et 6 réunions « médicales » ou « professionnelles », les 30/01/2014, 28/03/2014, 29/03/2014, 20/05/2014, 14/10/2014 et 15/12/2014) et 76 avantages perçus.
Bref, tous les experts de l’AFEF impliqués dans l’élaboration de ces nouvelles recommandations présentent des liens d’intérêts majeurs, au sens du guide de la HAS…
Ces recommandations sont-elles biaisées ?
L’argumentation sur laquelle se fondent ces experts (page 13) correspond en tous points au « mensonge par omission » que nous avons relevé dans la vidéo du Pr Lawrence SERFATY. Elle fait l’amalgame entre les études faites avec l’interféron, les seules à avoir démontré un bénéfice sur la morbi-mortalité, et celles n’ayant établi qu’une efficacité virologique avec les nouveaux traitements…
L’AFEF recommande à court terme un traitement universel pour tous les patients porteurs chronique du virus de l’hépatite C.
L’AFEF dicte donc ses indications à la DGS…
Il va falloir que les pouvoir publics se montrent un peu plus énergiques et rapidement, sans quoi nous auront prochainement 200.000 malades à traiter à 41.861 €, soient plus de 8 milliards d’euros, bien que 4% seulement d’entre-eux évolueront en 20 ou 30 ans vers une cirrhose. L’hépatite C chronique nous offrirait alors l’un des plus bel exemple de surtraitement et de surdiagnostic…
Les anomalies, les bugs et les imperfections de la base de données Transparence.sante.gouv.fr, dont la gestion semble défectueuse
Il n’est pas inutile de partager les difficultés rencontrées lors de ce travail de recherche.
Nous n’allons pas revenir sur tous les problèmes déjà mentionnés ailleurs (voir la vidéo ici pendant 3 minutes jusqu’à 41:07) à l’occasion d’un travail précédent également publié sur le site du Formindep (« Les leaders d’opinion d’une firme pharmaceutique influencent la rédaction du Point – Parcours du combattant pour l’exercice d’un journalisme indépendant » ici), de manque de convivialité, d’évaporation de données (présentes dans la base du CNOM et curieusement absente de celle du ministère), de l’absence d’information sur les congrès et manifestations scientifiques (les programmes étaient téléchargeables sur le site du CNOM, ils ne le sont plus sur celui du ministère), d’impossibilité d’exporter les résultats d’une recherche dans un fichier Excel…
Signalons juste que l’accès à la recherche a été rendu encore plus difficile, puisque au lieu de saisir une seule lettre, il faut désormais en entrer 5 à chaque recherche
Nous prendrons juste un exemple qui illustre parfaitement la mauvaise gestion des entrées de données dans la base, à l’origine d’erreurs, dont il est difficile d’estimer la fréquence, qui pourraient aller jusqu’à compromettre la fiabilité des travaux…
Le nouveau chef du service Hépatologie de l’hôpital Beaujon, porte le nom fort répandu de « DURAND ». Lorsqu’on le rentre dans le moteur de recherche, nous trouvons 1.409 résultats concernant les professionnels de santé, qui s’étalent sur 71 pages. Notre Professeur se prénomme « François » et il faut déjà se rendre à la page 24, pour commencer la sélection au moyen de cases à cocher. Prenons bien soin de ne cocher que les François DURAND à Clichy. Curieusement, il n’est pas possible de faire une recherche sur le nom et le prénom…
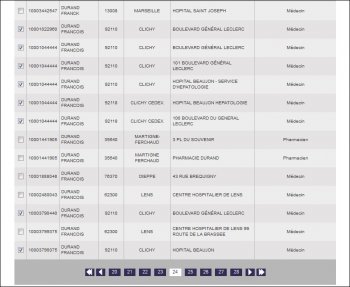
Il y en a aussi sur la page 25 :
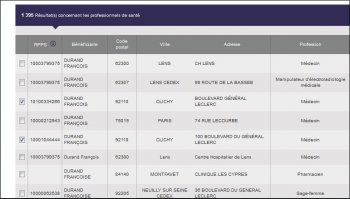
Nous avons donc la surprise de découvrir 5 N°RPPS différents pour le Dr DURAND François, médecin à Clichy (92) :
- 10001022960
- 10001044444
- 10003790440
- 10003799375
- 10100334266
En cochant sur le formulaire d’interrogation de la base « DURAND François à Clichy ou Paris », n’est-il pas étonnant d’obtenir sur la page de résultats d’autres médecins ?
10003799375 = DURAND François, Manip radio à Lens (62),
10100334266 = DURAND Matthieu, médecin, chirurgie urologique à Nice (01),
10100334266 = DURAND Matthieu, étudiant, hôpital de l’Archet, Nice (01),
10000212943 = DURAND PASQUER François Xavier, médecin ORL, HEGP, Paris (75),
10001022960 = PARQUIN François, médecin pneumologie réanimation (commission nationale d’évaluation des dispositifs médicaux et technologie de santé, HAS, St-Denis (93)
10003790440 = PASQUALE Joseph, médecin, professeur, chirurgie urologique, Chalon-sur-Saône, (71)
10003799375 = SCHAWLIEGE Julie, médecin, spécialité non précisée, CH Beauvais (60)
Encore heureux que nous n’ayons pas coché les autres DURAND François :
10001441905 = DURAND François, pharmacien, Martigne-Ferchaud (35)
10001888048 = DURAND François, médecin, Dieppe (76)
10002480043 = DURAND François, médecin, CH Lens (62)
10003799375 = DURAND François, médecin, CH Lens (62)
A noter que « DURAND PASQUER François Xavier » s’affiche « DURAND François » dans l’écran de sélection :
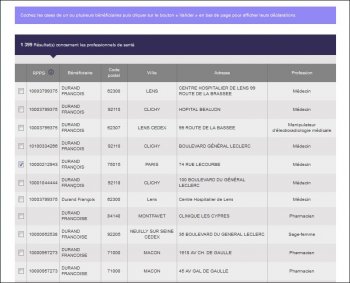
Et que ce n’est qu’une fois sur les écrans de résultats de la recherche, qui listent les avantages perçus et conventions signées, qu’il est possible de se rendre compte de la « méprise » :
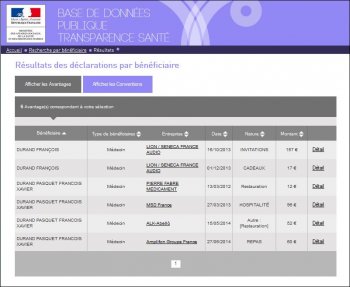
Et encore pas toujours, puisque sur les 2 deux premières lignes en cliquant sur « détail » il s’avère qu’une erreur de saisie a été commise puisque le N°RPPS est bien celui de François Xavier DURAND PASQUET, mais ses nom et prénom ont été tronqués :
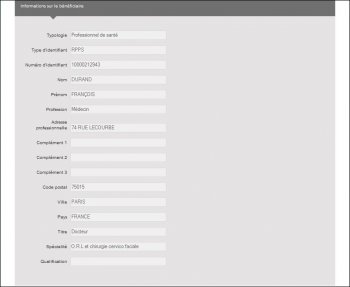
Il semble donc indispensable que les firmes et le ministère sécurisent les entrées dans la base de données en s’appuyant sur le fichier des N°RPPS. Il est invraisemblable que les informations telles que prénom, nom, adresse, profession, spécialité, qualification, soient ressaisies à chaque enregistrement avec le risque d’erreur que cela comporte !
En utilisant la recherche avancée, il est possible d’entrer un N°RPPS. Par exemple, saisissons le premier N°RPPS identifié pour François DURAND :
La copie d’écran suivante montre que le N°RPPS « 10001022960 » a été utilisé pour 3 bénéficiaires différents pour entrer dans la base de données des enregistrements de conventions signées :
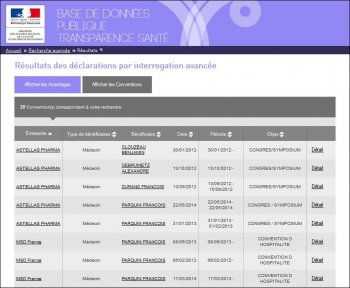
En ayant cliqué sur l’écran de sélection uniquement les François DURAND de Clichy (92), la convention signée avec SIEMENS est attribuée à ce médecin, mais en cliquant sur « détail », il s’avère que c’est le manip-radio de Lens qui est concerné par cette convention et qui remonte par erreur :
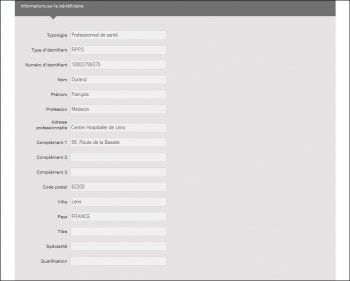
Ces erreurs sont très fâcheuses et il n’est malheureusement pas possible de tout vérifier.
Annexes – Arguments médicaux permettant de qualifier d’excessifs et de prématurés les propos de type « guérison totale, définitive ; éradication du virus »
Commençons par jeter un œil sur ces fameux nouveaux antiviraux utilisés dans l’hépatite C chronique :
La première évolution depuis l’association interféron + ribavirine, traitement de référence depuis une quinzaine d’année, a été permise par l’arrivée de deux inhibiteurs des protéases du VHC, d’abord VICTRELIS®, bocéprévir (MSD France) qui obtint son AMM en août 2011, suivi d’INCIVO®, télaprévir (Janssen-Cilag) commercialisé en juillet 2012. L’ajout d’une antiprotéase à la bithérapie chez des patients naïfs de traitement infectés par un virus de l’hépatite C de génotype 1, permet de passer de 50% à 80% de réponse virologique prolongée, mais au prix d’effets indésirables graves, notamment hématologiques ou cutanés, parfois mortels (Revue Prescrire “Hépatite C : le Sofosbuvir une avancée évaluée a minima”, “L’évaluation de sofosbuvir vue de divers pays”). A propos de cas mortels, soulignons que l’agence française du médicament (ANSM) n’a pour l’heure (vérification faite le 22 mars 2015) pas fait d’autre mise en garde sur le télaprévir que celle du 8 avril 2013 (ici) où elle signalait deux cas de syndrome de Lyell, dont un décès, rapportés au Japon. Or, il s’avère qu’en mai 2014, l’ISMP américain dans son analyse trimestrielle portant sur les déclarations d’effets indésirables à la FDA du 1er trimestre 2013, 131 cas graves d’hypersensibilité, dont 14 décès avaient été notifiés ainsi que 105 cas de réactions cutanées sévères (dossier téléchargeable ici). Comment l’agence française peut-elle encore en 2015 ignorer les données de pharmacovigilance d’un pays 5 fois plus peuplé que le notre et où les molécules sont commercialisées le plus souvent bien avant leur autorisation en Europe et en France, ce qui donne à ce pays une antériorité d’expérience dans la « vraie vie ».
La commission de la transparence de la HAS ne s’y est d’ailleurs pas trompée (sur la mauvaise tolérance de ces molécules), leur accordant le 14 mai 2014 une ASMR IV (progrès mineur). Janssen-Cilag a d’ailleurs décidé de retirer INCIVO® du marché à compter du 30 avril 2015. OLYSIO®, siméprévir, nouvel inhibiteur de la protéase de Janssen-Cilag (AMM en juin 2014) n’est pas mieux loti, avec une ASMR mineur (avis du 17/12/2014, modifié le 22/01/2015), il est logé par la commission de la transparence à la même enseigne que les deux autres. Les laboratoires Boehringer Ingelheim ont annoncé en juin 2014 le retrait de leur demande d’AMM européenne pour le faldaprévir, un autre inhibiteur de protéase, en raison probable d’un rapport bénéfice risque peu favorable (ici).
Un pas probablement plus important a été réalisé avec l’arrivée du SOVALDI®, sofosbuvir, de Gilead Sciences (AMM en janvier 2014, mais longue négociation de son prix avec le CEPS), qui associé à la bithérapie de référence, permet d’obtenir une réponse virologique prolongée chez environ 90% des patients, avec un profil de tolérance plus favorable dans les essais cliniques que ceux rapportés avec les inhibiteurs de protéase. Néanmoins, et compte-tenu de l’absence de bénéfice démontré sur les critères de morbi-mortalité, la Commission de la transparence HAS a été très généreuse d’accorder une ASMR II (progrès important, avis également donné le 14 mai 2014) sur un critère intermédiaire… D’autant que le prix accordé finalement le 17 novembre 2014 (Une date à marquer d’une pierre blanche pour le laboratoire américain, qui s’est vu accorder le même jour une AMM européenne pour HARVONI®), fut proche de 500 € par comprimé (498,35 € HT), soient 41.861,40 € de coût de traitement pour une cure de 12 semaines. Un coût extrêmement élevé, même s’il est en baisse par rapport aux 56.000 € facturés à l’assurance maladie entre janvier et novembre 2014 (prix imposé par le laboratoire sous le régime de l’ATU, prolongé pendant la longue négociation du prix avec le CEPS). Un dispositif très abscons a été adopté dans la Loi de financement de la sécurité sociale 2015 pour que Gilead rembourse une partie de son chiffre d’affaire 2014 (proche du milliard d’euros), il sera intéressant de voir quelle en sera la réalité…
DAKLINZA®, daclatasvir de Bristol-Myers Squibb (AMM en octobre 2014), ne semble pas apporter grand-chose de nouveau, avec une ASMR (IV) le progrès apporté par cet autre antiviral à action directe, a été jugé mineur (avis du 17/12/2014) par la HAS.
La place dans la stratégie thérapeutique de l’association sofosbuvir + lédipasvir, commercialisée sous le nom d’HARVONI® par Gilead Sciences (AMM en décembre 2014), et l’amélioration du service médical rendu n’ont été précisées que récemment par la HAS : “progrès mineur (ASMR IV) par rapport aux autres associations actuellement disponibles avec le sofosbuvir” (avis du 04/03/2015 mis en ligne le 01/04/2015, ce n’est pas un poisson d’avril !).
Enfin, 3 autres médicaments, dont une association de 3 antiviraux, utilisés dans le traitement de l’hépatite C chronique restent à ce jour sous le régime de l’ATU (voir le tableau en début d’article).
Point important aussi, les firmes se sont bien gardées de mener des études comparatives entre antiviraux à action directe. Toutes les études comparent les nouveaux antiviraux au placebo. Il est alors d’autant plus difficile, pour ne pas dire hasardeux, de comparer deux à deux les résultats des différentes études (portant toutes pour le moment, rappelons-le, sur la seule efficacité virologique) car il existe de très nombreux facteurs confondants (variable susceptible d’induire un biais dans l’analyse du lien entre maladie et facteur de risque). En effet, les individus ne sont pas égaux quant à leurs chances d’éradication du virus de l’hépatite C par un traitement donné. Citons au premier plan :
- l’immunité du patient,
- son âge,
- la consommation excessive d’alcool,
- le sexe masculin (les femmes sont mieux protégées que les hommes),
- la co-infection par le VIH,
- la consommation de tabac, et encore plus celle du cannabis,
- la charge virale,
- le génotype du virus,
Même la consommation élevée de café (à partir de 3 tasses par jour) est associée à un taux de réponse virologique prolongée au traitement interféron + ribavirine deux fois supérieur à celui d’une faible consommation (étude publiée dans Gastroenterology en juin 2011 en accès libre : ici).
Examinons à présent quelques unes des références bibliographiques citées dans l’excellent dossier de la Revue Prescrire datant d’octobre 2014 :
Les recommandations de l’EASL (association européenne d’étude du foie pour « European Association for the Study of Liver », dont nous avons vu le financement par les firmes pharmaceutiques), publiées en avril 2014 et téléchargeables ici (22 pages), indiquent que :
- pour les patients non cirrhotiques indétectables 12 semaines après l’arrêt du traitement, un nouveau test 36 semaines plus tard permet de confirmer l’éradication du virus,
- les patients présentant d’autres risques (passé alcoolique, diabète de type 2) doivent faire l’objet régulièrement d’un examen clinique approfondi,
- les patients cirrhotiques indétectables devraient être maintenus sous surveillance d’un carcinome hépatique (ultrasons) tous les 6 mois, et de varices œsophagiennes (endoscopie),
- Le problème d’une réinfection causée par un comportement à risque récurrent ou persistant demeure. Ce risque serait compris entre 1-5% par an
Le rapport de l’AHRQ (équivalent US de notre HAS) de novembre 2012 sur l’efficacité comparative des traitements den l’hépatite C chronique de l’adulte (Rapport complet (387 pages) téléchargeable ici, Synthèse (4 pages) accessible là), mentionne que :
- le risque de développer une cirrhose au bout de 25 ou 30 ans pour un patient infecté par le VHC est de 5 à 25%,
- Aucune étude n’a comparé directement l’efficacité clinique à long terme des médicaments de l’hépatite C chronique,
- Une (seule) étude importante de cohorte avec contrôle correct des variables confondantes a montré une réduction de la mortalité toutes causes chez les patients ayant une réponse virologique prolongée (risque relatif compris entre 0.51 et 0.71, selon le génotype du virus) avec l’association interféron + ribavarine (étude téléchargeable ici)
- les autres études de cohorte qui concluent dans le même sens sont plus petites, et de méthodologie plus critiquable,
L’étude du JAMA 2012 cité par Prescrire (téléchargeable ici), conduite chez 530 patients avec fibrose avancée (54% avaient un stade 6, 19% un stade 5 et 27% un stade 4 selon le score Ishak) ayant débuté un traitement à base d’interféron entre 1990 et 2003, avec un suivi moyen de 8,4 ans, montre :
- Un taux de mortalité toutes causes à 10 ans de 8,9% chez les patients ayant présenté une réponse virologique prolongée, contre 26,0% pour les autres (P<0.001),
- Une incidence à 10 ans de décès lié à la maladie hépatique ou de transplantation chez seulement 1,9% des patients avec réponse virologique soutenue versus 27,4% chez ceux sans (p<0,001),
- Une incidence à 10 ans d’un carcinome hépatocellulaire chez 5,1% des patients répondeurs contre 21,8% pour les non répondeurs (p<0,001),
- Une incidence de l’insuffisance hépatique à 10 ans chez 2,1% des réponses virologiques prolongées, contre 29,9% (p<0,001) chez les autres,
Il s’agit assurément de l’étude la plus solide portant sur des critères de morbi-mortalité, mais comme chacun aura pu le constater, elle a inclus exclusivement des patients présentant une fibrose sévère (F3) et traités avec l’interféron.
Cette étude est également citée par le groupe 9 « Conséquences cliniques et traitement de l’infection par le virus de l’hépatite C » du rapport « DHUMEAUX »
Nous avons réalisé une recherche bibliographique complémentaire portant notamment sur la période récente à l’aide de deux requêtes dans PubMed, pour croiser la présence dans le résumé (abstract » des mots-clés suivants : « réponse virologique prolongée » (« SVR » en anglais) et « hépatite C » (« hepatitis C ») et « mortalité toutes causes » (All-causes mortality ») : ici, ou et « carcinome hépatocellulaire » ici
Voici quelques « morceaux choisis » :
La méta-analyse la plus récente, publiée en avance le 17 mai 2015 dans Clinical Infectious Diseases sous forme d’un manuscrit accepté (téléchargement libre ici), regroupe les 31 études ayant rapporté le taux de mortalité chez les patients porteurs chronique du virus de l’hépatite C avec ou sans réponse virologique soutenue, soit au total 33.360 patients. Dans ce travail anglais, avec un suivi médian de 5,4 années, le HR ajusté pour la mortalité est de 0,50 (IC 95% : 0.37-0.67) sur l’ensemble des patients inclus ayant une réponse prolongée par rapport à ceux en échec de traitement, de 0,26 (IC 95% : 0,18-0,74) chez les patients cirrhotiques et de 0,21 (0,10-0,45) chez les patients co-infectés VIH et VHC. Le tableau 1 (page 16 et 17 du document), reproduit ci-dessous, qui détaille les populations incluses dans les études analysées, est sans équivoque : Tous les patients de cette méta-analyse ont été traités avec l’interféron associé ou non à la ribavirine…
Vous pouvez cliquer sur l’image et chercher avec la loupe, vous ne trouverez pas les nouveaux antiviraux dans les études retenues pour cette méta-analyse datant de mai 2015.
Une revue générale publiée en janvier 2015 dans BMC Infectious Diseases, téléchargeable sur Biomed Central (ici). Elle a analysé toutes les études ayant inclus 100 patients et plus, publiées en langue anglaise entre 2002 et 2013, et rapportant les résultats en termes de morbi-mortalité, incluant le carcinome hépatocellulaire, la mortalité liée à la maladie du foie, la mortalité toutes causes, les complications (hypertension portale, varices œsophagiennes). D’après cette revue, la réponse virologique prolongée est durable, puisque le taux de rechute à 4 ou 5 ans est compris entre 1% et 2%. Lorsque le virus devient indétectable après traitement, une certaine régression de la fibrose ou de la cirrhose est observée, ainsi qu’une réduction substantielle du risque de carcinome hépatocellulaire (risque relatif
[RR] compris entre 0,1 et 0,25), de mortalité liée à la maladie hépatique (RR 0,03-0,2), de mortalité toutes causes (RR 0,1-0,3) par rapport à l’absence ou à l’échec du traitement.
Une étude écossaise de cohorte observationnelle portant sur 3.385 patients, traités entre 1996 et 2011 (uniquement par interféron associé ou non à la rivabirine, compte tenu de la période), avec une médiane de suivie de 5,3 années publiée en février 2015 dans Hepatology (résumé accessible ici). La réponse virologique prolongée est associée à une réduction de la mortalité d’origine hépatique (odds ratio ajusté = 0,24 p<0,001), de la mortalité non liée à une maladie du foie (HR ajusté = 0,68 p<0,026), de la mortalité toutes causes (HR ajusté = 0,49 p<0,001) ; Fait notable, la réduction du risque absolu de mortalité est nettement plus importante pour les patients sévèrement atteints.
Une importante cohorte observationnelle du Veterans Affairs a étudié l’impact du génotype du virus sur la réduction de la mortalité totale après réponse virale prolongée au traitement interféron + ribavirine. Ce travail publié en juin 2011 dans Clin Gastroenterol Hepatol (téléchargeable ici). Les auteurs ont sélectionné tous leurs patients porteurs chronique d’un virus de génotype 1, 2 ou 3, non co-infectés par le VIH, et exempts de carcinome hépatocellulaire au début du traitement par interféron pégylé + ribavirine, qui avait débuté le traitement antiviral entre janvier 2001 et juin 2007 et l’avait stoppé en juin 2008. Au total, les 12.166 patients avec génotype 1, 2.904 de génotype 2 et 1.794 de génotype 3, ont obtenu un taux de réponse virologique prolongée respectivement de 35%, 72%, et 62%. La réduction du risque de décès toutes causes pour les patients répondeurs par rapports aux autres est de 30% pour le génotype 1 (HR 0,70 p<0,0001), 36% pour le génotype 2 (HR 0,64 p<0,006) et de 49% pour le génotype 3 (HR 0,51 p<0,0002).
Une étude de cohorte italienne avec un très long suivi pour quelques patients publiée en mai 2013 dans World J Gastroenterol a analysé les données de 150 patients avec réponse virologique soutenue entre 1989 et 2008, sous traitement par interféron pégylé ou non avec ou sans ribavirine (accessible ici). Le suivi médian est de 8,6 années (2 à 19,9). 137 patients avaient une hépatite C virale chronique et 13 une cirrhose. Aucune récurrence du virus n’a été retrouvée, deux cas seulement de carcinome hépatocellulaire et un cas de rupture de varices œsophagienne ont été observés. Une réduction de la fibrose hépatique a été constatée chez 70% des 137 patients biopsiés.
Une méta-analyse de 30 études observationnelles portant sur l’impact de la réponse virologique prolongée sur l’apparition de carcinomes hépatocellulaires, publiées en mars 2013 dans Annals of Internal Medicine (téléchargeable ici). Les 30 cohortes ont inclus 31.528 patients infectés du virus de l’hépatite C, dans 17 pays, ayant fait l’objet d’un suivi moyen d’au moins 2 ans (suivi médian compris entre 2,5 et 14,4 années). Une réponse virologique soutenue a été obtenue pour 34,4% des patients et 5,5% des patients ont développé un carcinome hépatocellulaire. L’analyse de 12 études qui avaient cherché à ajuster les résultats sur les variables confondantes telles que l’âge, la co-infection avec le virus de l’hépatite B, a permis de montrer que seulement 1,5% des patients (145 patients / 9.185) bons répondeurs a développé un carcinome hépatocellulaire, contre 6,2% pour les non répondeurs (990/). Le niveau de preuve est jugée modeste.
Une revue systématique et méta-analyse de 8 essais cliniques randomisés et de 5 études de cohorte observationnelle portant sur des patients présentant une hépatite C chronique avec cirrhose ou fibrose publiée dans la BMJ en octobre 2012 (téléchargeable ici). La méta-analyse portait sur des études publiées entre 1997 et 2011, 1.674 patients (dans 2 essais randomisés) ont été traités par interféron pégylé (ou placebo), 1.433 patients (dans 5 essais randomisés et les 5 études observationnelles de cohorte) recevaient de l’interféron (ou le placebo), enfin dans un essai randomisé, les 101 patients recevaient de l’interféron + ribavirine (ou placebo). 2456/3208 patients (77%) avaient une cirrhose. Le traitement antiviral réduit l’incidence d’un carcinome hépatocellulaire (81/1156 versus 129/1174 ; risk ratio 0.53, 95% CI 0.34 to 0.81). L’analyse en sous-groupes montre que le traitement antiviral est plus bénéfique chez les patients qui obtiennent une réponse virologique prolongée (0.15, 0.05 to 0.45 versus 0.57 ; 0.37 to 0.85).
Le suivi 35 ans après contamination par le virus de l’hépatite C d’une cohorte allemande de 718 patients publié en janvier 2014 dans Hepatology (résumé téléchargeable ici). Sur l’ensemble de la cohorte, 9,3% des patients ont développé une cirrhose 35 ans après leur contamination. Ce taux monte à 15,3% (28/183) chez les non répondeurs au traitement antiviral (interféron pégylé + ribavirine), et s’abaisse à 6% (9/149) chez les patients pour lesquels le traitement a produit une réponse virologique prolongée. La réponse virologique prolongée diminue significativement la mortalité toutes causes (p=0,027). Respectivement, il a été observé 7 décès dont 5 liés à la cirrhose versus 1 décès lié à une cirrhose) ;
Etude de cohorte menée chez 536 patients porteurs d’une hépatite C chronique traités entre 1997 et 2009, publiée dans Digestive Diseases and Sciences en avril 2014 (résumé accessible ici). Un décès d’origine hépatique et non hépatique après un suivi médian de 7,5 années est survenu respectivement chez 2,7% et 5% des patients répondeurs au traitement versus 17,8% et 6,4% des non répondeurs.
Enfin, la méta-analyse présentée par le Pr SERFATY dans la 4ème vidéo au début de l’article, fait référence à un abstract présenté lors du congrès ASSLD 2014 à Boston : ici. Comme l’indique en bas de la page la rubrique « limites de l’étude », au niveau du 3. : « Les résultats sont présentés pour une réponse virologique soutenue après traitement à base d’interféron pégylé. Nous n’avons pas de données de suivi à long terme après réponse virologique prolongée avec un traitement à base d’antiviraux à action directe » (Traduction de l’anglais ; « Results are shown for SVR after pegylated-interferon based treatment. We do not have data on long-term outcomes for SVR after DAA based treatment ». SVR = Sustained Virologic Response ; DAA = Direct-Acting Antiviral)
Pour terminer, quelque liens utiles :
Site et blogs recommandés sur une liste internationale comprenant les rédacteurs en chefs des plus grandes revues médicales :
« Trop beau pour être vrai » :http://hcrenewal.blogspot.fr/2014/03/too-good-to-be-true-sovaldi-kerfuffle.html
« Doit-on suivre le dépistage de l’hépatite C recommandé par le CDC » :http://www.kevinmd.com/blog/2012/10/cdc-recommends-hepatitis-screening.html
« Décortiquer la recommandation de dépistage de l’hépatite C » :http://commonsensemd.blogspot.fr/2012/11/dissecting-hepatitis-c-screening.html
« Aucun traitement ou vaccin pour le virus Ebola, mais de pilules à 1000 dollars dans l’hépatite C » :http://hcrenewal.blogspot.fr/search/label/Sovaldi
« Un nouveau deal pour big pharma, l’acquisition par Merck d’Idenix pour 3,85 milliards de dollars » :http://fortune.com/2014/06/09/merck-idenix-acquisition/
L’ensemble de ces travaux montre à l’évidence qu’il très prématuré de parler de « guérison totale, définitive, complète… » et « d’éradication à 100% du virus »













Bonjour Monsieur, en cherchant “conflits d’intérêt je suis tombée sur votre article, je me suis permise de le partager sur facebook, comment ça se fait que ce que vous avez écrit ne soit pas ressorti actuellement avec ce qui se passe??? ce serait bien de faire part au moins aux médias de ces personnes qui conseillent actuellement le gouvernement… Merci beaucoup
Bonjour et merci de votre commentaire. Justement, dans un fil sur twitter, j’ai analysé les conflits d’intérêts des médecins membres du Conseil Scientifique “pour l’éclairage de la décision publique dans la gestion de la pandémie COVID-19”, en orientant notamment les internautes vers mon article sur le site du FORMINDEP à propos du Pr Jean-François DELFRAISSY; Vous pourrez suivre ce lien : https://twitter.com/fpesty/status/1239504666980945920 et cliquer sur “Afficher la discussion” pour ouvrir tous les tweets de ce fil. Bien à vous.
Bonjour monsieur Pesty, vous dites des choses très importantes. pouvez-vous me contacter par mail ou pas messagerie privée twitter (je viens de m’abonner à votre compte) ? Bien à vous.